Parler d’études cliniques, c’est faire référence à la série d’études scientifiques réalisées chez l’homme qui valident les étapes de recherche et de développement lors de la découverte d’un nouveau médicament.
Il s’agit d’une étape indispensable et soumise à des contrôles réglementaires rigoureux, pour permettre la mise sur le marché et l’utilisation optimale d’un médicament afin d’assurer son bénéfice thérapeutique pour les patients.
Les études cliniques peuvent durer plusieurs années et répondent à une organisation précise qui respecte le protocole de recherche, afin d’assurer notamment la sécurité des participants.
La recherche clinique, ou l’exigence de la rigueur scientifique
La recherche clinique correspond à l’ensemble des études scientifiques réalisées sur des personnes volontaires afin de développer des médicaments et des dispositifs médicaux1. Les études cliniques se déroulent généralement en milieu hospitalier ou en cabinet médical, sous la responsabilité des médecins.
Les études cliniques permettent d’évaluer la sécurité, l’efficacité et les modalités d’utilisation du traitement, chez l’homme, afin de pouvoir demander la mise sur le marché d’un nouveau médicament. Elles imposent l’application d’une méthode scientifique rigoureuse afin de garantir à la fois le bénéfice thérapeutique de la solution éprouvée et la sécurité des participants. En plus de son intérêt thérapeutique, la recherche clinique participe aussi au développement des connaissances sur le plan médical et biologique2.
Quatre phases d’études cliniques
La validation des études pré-cliniques est un prérequis au démarrage des études cliniques. Il s’agit de tester la molécule étudiée sur l’animal avant l’administration du candidat-médicament à l’homme.
Le développement d’un nouveau médicament est composé classiquement de quatre phases successives d’études cliniques, qui ont pour objectif d’observer les effets du médicament dans le corps humain et de mesurer son efficacité.
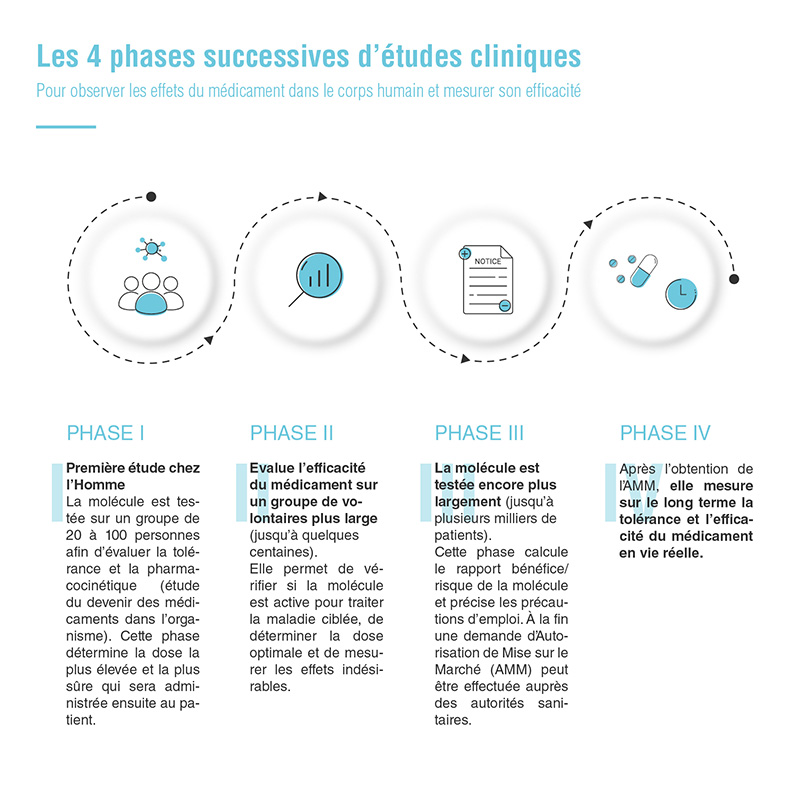
Actuellement, seul un médicament sur dix franchit toutes les étapes3. Toutefois, pour l’oncologie ou pour une maladie rare, le processus de développement clinique d’un médicament peut être accéléré : le nombre de patients peut être inférieur et certaines phases de développement peuvent être combinées.
Laboratoires, chercheurs, médecins, patients… tous mobilisés !
Les études cliniques durent généralement plusieurs années, parfois jusqu’à dix ans, et mobilisent au quotidien de nombreux acteurs afin de trouver de nouvelles solutions thérapeutiques indispensables pour soigner les patients.
Les laboratoires pharmaceutiques sont, le plus souvent, à l’initiative des études cliniques, ainsi que de leur financement. Toutes les études cliniques sont menées par des professionnels de santé habilités, appelés « investigateurs ». Ils sont en charge de leur bonne conduite, et ont la responsabilité de l’inclusion des patients dans l’étude et de leur sécurité. Quant aux participants, ils sont toujours volontaires.
Assurer la transparence des résultats dans un cadre juridique rigoureux
Pour démarrer une étude clinique, différentes autorisations sont nécessaires auprès des autorités compétentes de chaque pays. Les délais d’approbation varient d’un pays à l’autre (de 30 jours jusqu’à plus de 200 jours).
Chaque participant doit recevoir par écrit toutes les informations relatives à l’étude (incluant les avantages et les risques) et doit donner son accord en signant un consentement avant de pouvoir être sélectionné. Le code de Nuremberg et la déclaration d’Helsinki de 1964, ainsi que leurs mises à jour successives, définissent les aspects éthiques de la recherche médicale dans le monde.
La publication des résultats d’une étude clinique constitue un intérêt majeur pour la recherche car elle permet d’assurer la transparence des résultats, qu’ils soient positifs ou négatifs. La déclaration d’Helsinki précise que « tout étude clinique doit être enregistrée dans une base de données accessible au public avant que ne soit recrutée la première personne impliquée dans la recherche ».

DE NOUVEAUX DÉFIS À RELEVER
Digitalisation des études cliniques : l’accélération du virage numérique constitue un défi pour tous les acteurs de la santé. La digitalisation des études cliniques peut s’avérer utile car elle permet de faciliter la participation de patients vivant à distance des centres investigateurs, d’améliorer leur observance (grâce à la réception de notifications par exemple) et d’accéder plus facilement aux données en temps réel.
Les patients au cœur de la recherche : principaux acteurs des études cliniques, les patients sont de plus en plus impliqués dans le processus de recherche et développement des laboratoires. Ils sont les mieux placés pour parler de leur maladie, de son évolution et des effets des traitements ressentis. L’implication des patients, le plus en amont possible, permet d’accélérer la recherche et de délivrer des traitements qui seront les mieux adaptés à leurs besoins.

ET SERVIER ?
1 https://clinicaltrials.servier.com/about-clinical-trials/
2 https://www.inserm.fr/recherche-inserm/recherche-clinique
3 https://www.leem.org/recherche-et-developpement
4 https://www.clinicaltrials.gov/ct2/help/glossary/phase
5 Goldacre Ben, DeVito Nicholas J, Heneghan Carl, Irving Francis, Bacon Seb, Fleminger Jessica et al. Compliance with requirement to report results on the EU Clinical Trials Register: cohort study and web resource BMJ 2018; 362 :k3218
